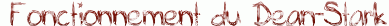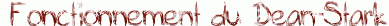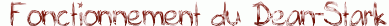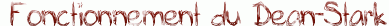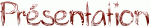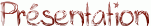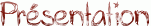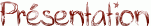
Lorsque l'on met un alcool et un acide carboxylique en contact, il se forme un ester : c'est la réaction d'estérification dont le bilan est le suivant :


Afin que l'équilibre s'établisse plus rapidement on chauffe le milieu réactionnel et on utilise une catalyse acide (voir mécanisme).
La réaction inverse est appelée l'hydrolyse de l'ester.
Le rendement de l'estérification dépend de la classe de l'alcool utilisé : un alcool de classe moins élévée donnera un meilleur rendement. Cependant il faut noter que ce dernier sera limité quelque soit la classe de l'alcool, rendant la réaction inutilisable en pratique. Il est donc nécessaire de l'optimiser. Pour cela on peut procéder de différentes manières :
- en se plaçant en large excès d'un des réactifs (en utilisant l'alcool comme solvant par exemple)
- en utilisant un agent de couplage
- en élminant un des produits au fur et à mesure de la réaction (souvent l'eau à l'aide d'un Dean-Stark)
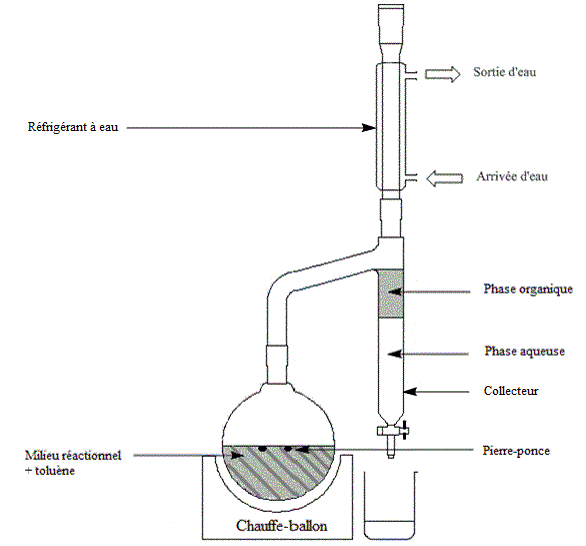 | Quand on utilise le Dean-Stark pour une estérification, on ajoute au milieu réactionnel (acide carboxylique + alcool) un solvant d'entraînement (non miscible à l'eau et moins dense que celle-ci : le toluène par exemple) qui forme un hétéroazéotrope avec l'eau créée par la réaction. On abaisse ainsi la température d'ébullition du mélange et, lorsque celle-ci est atteinte, une vapeur de composition azéotropique s'échappe en entraînant l'eau hors du milieu réactionnel. Cette vapeur se condense ensuite dans le collecteur et, comme le solvant est moins dense que l'eau, il occupe la partie supérieure pour être recyclé en retombant dans le ballon. Il suffit ensuite de vider régulièrement l'eau du collecteur grâce au robinet. |