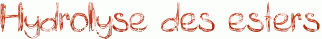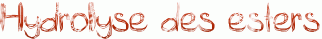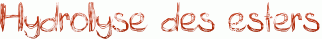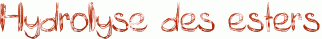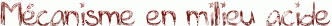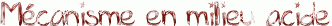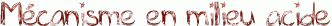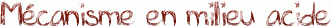
L'hydrolyse d'un ester en milieu acide n'est autre que la réaction inverse de la réaction de Fisher présentée ici. Il suffit donc de reprendre ce mécanisme étape par étape dans le sens inverse.
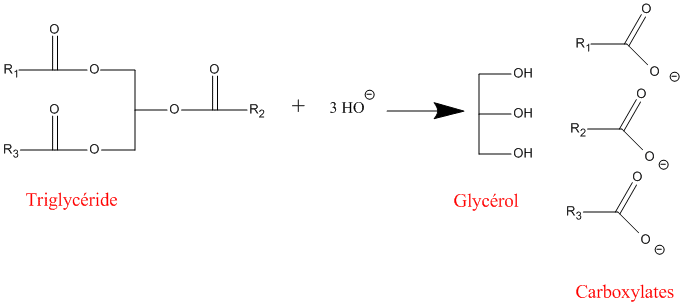
Voici le mécanisme de l'hydrolyse d'un ester en milieu basique : il s'agit de la saponification.
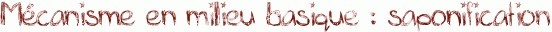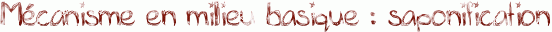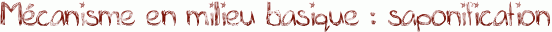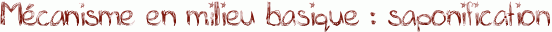
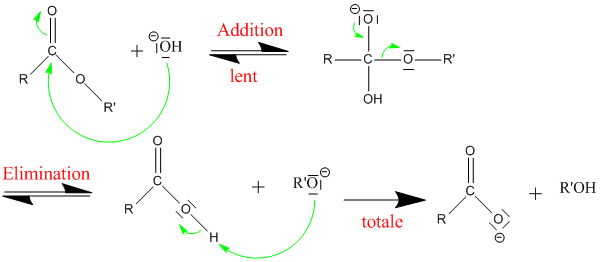
La saponification est utilisée pour la synthèse du savon. Pour ce faire, on hydrolyse des corps gras ( triglycérides ) en utilisant de la soude NaOH, ou de la potasse KOH à 100°C environ. Le chauffage permet d'accélérer la réaction. On obtient alors du glycérol et des carboxylates. Ces carboxylates sont les constituants du savon.