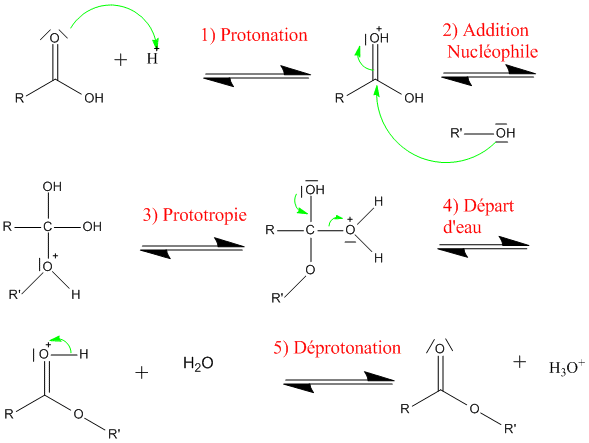
Voici le mécanisme de l'estérification de Fischer avec une catalyse acide :
On constate que le proton utilisé pour améliorer la cinétique de la réaction est restitué : il s'agit bien d'un catalyseur.
Plus le pH de la solution est bas et plus la cinétique de la réaction d'estérification sera importante. On utilise souvent l'acide paratoluènesulfonique (APTSAPTS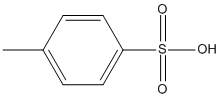 ) pour acidifier le milieu (voir glossaire pour plus de précision).
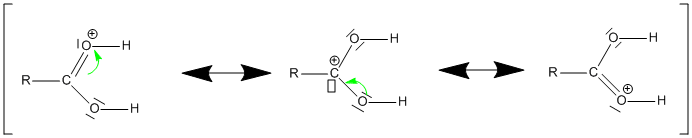
À la suite de la protonation du groupe carbonyle, on obtient un ion plus électrophile que l'acide carboxylique, et qui est stabilisé par mésomérie :
C'est pour cette raison que la protonation s'effectue sur la fonction carbonyle et non sur la fonction alcool qui d'ailleurs ne permettrait pas de poursuivre la réaction.
) pour acidifier le milieu (voir glossaire pour plus de précision).
À la suite de la protonation du groupe carbonyle, on obtient un ion plus électrophile que l'acide carboxylique, et qui est stabilisé par mésomérie :
C'est pour cette raison que la protonation s'effectue sur la fonction carbonyle et non sur la fonction alcool qui d'ailleurs ne permettrait pas de poursuivre la réaction.



 ) pour acidifier le milieu (voir glossaire pour plus de précision).
À la suite de la protonation du groupe carbonyle, on obtient un ion plus électrophile que l'acide carboxylique, et qui est stabilisé par mésomérie :
) pour acidifier le milieu (voir glossaire pour plus de précision).
À la suite de la protonation du groupe carbonyle, on obtient un ion plus électrophile que l'acide carboxylique, et qui est stabilisé par mésomérie :