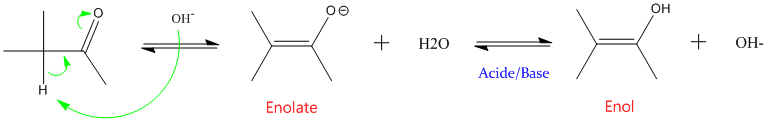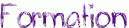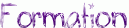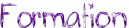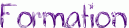Par la présence de la liaison C=O et l'absence d'hydrogène capable de former une liaison hydrogène, les dérivés carbonylés sont des molécules polaires aprotiques. De ce fait, ils sont principalement utilisés comme solvant.
En spéctroscopie IR (infra-rouge), on peut observer une bande caractéristique fine vers 1700 cm-1. En RMN du proton, cette fonction est fortement déblindante, c'est-à-dire que les signaux des hydrogènes proches d'une liaison C=O sont déplacés vers des valeurs plus grandes de déplacement chimique.
Les carbonyles possèdent un centre électrophyle au niveau du carbone, ce qui permet de réaliser des réactions d'additions nucléophiles.
Par exemple :
- Ils réagissent avec les organomagnésiens:
- Réaction de Wittig :
- Acétalisation et cétalisation :
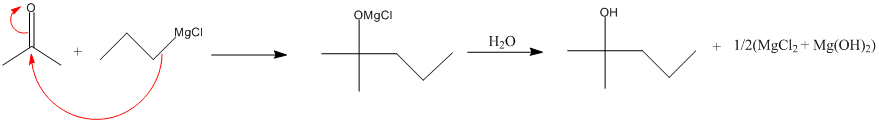
- Réaction de réduction par NaBH4 : En présence d'un alcool ( éthanol par exemple ) :
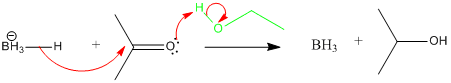
- Réaction de réduction par LiAlH4 :
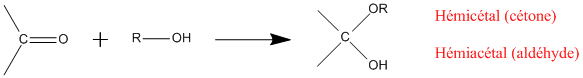
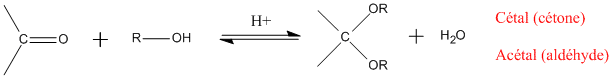
Les cétones et aldéhydes sont très présents dans la nature. Il existe cependant plusieurs voies de synthèse des carbonyles :
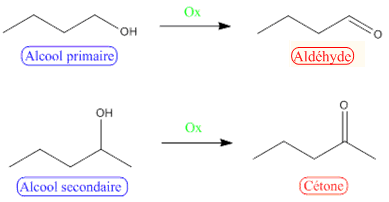
- Oxydation des alcools :
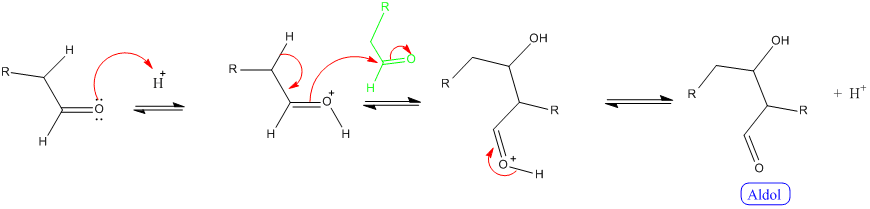
- Aldolisation : Cette réaction requiert la présence d'un hydrogène en α de la fonction carbonyle. Ce mécanisme peut se faire :
- en milieu acide :
- en milieu basique :
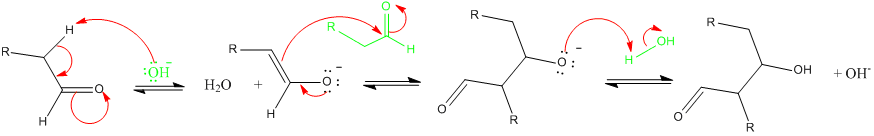
-
Cétolisation : Cette réaction présente le même mécanisme que l'aldolisation, avec une cétone cette fois :
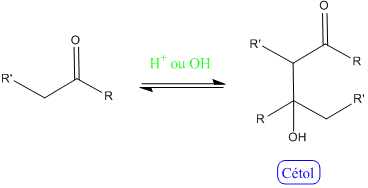
Remarque : Cette réaction est plus difficle à réaliser que l'aldolisation. - Ozonolyse :
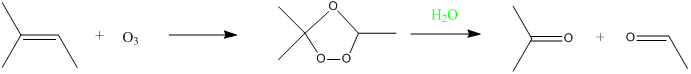
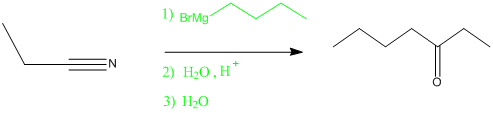
- Réaction entre un organomagnésien et un nitrile :
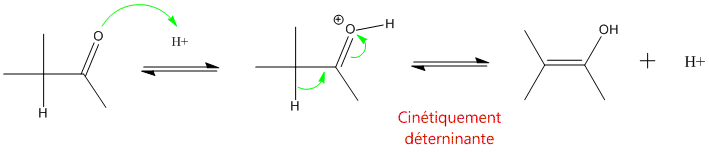
Les aldéydes et les cétones présentant un H en alpha présentent un équilibre entre la forme carbonylée et une forme isomére : l'énol.

- en milieu acide :
- en milieu basique :