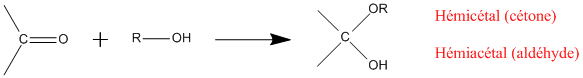
 L'addition nucléophile d'un alcool sur un composé carbonylé en milieu acide forme un hémicétal dans le cas d'une cétone ou un hémiacétal
dans le cas d'un aldéhyde.
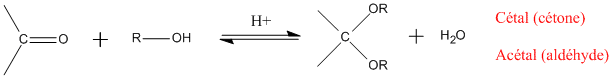
Lorsque la fonction carbonylée est mise en contact avec deux fonctions alcool, on obtient un cétal (pour une cétone) ou un acétal (pour un aldéhyde).
L'addition nucléophile d'un alcool sur un composé carbonylé en milieu acide forme un hémicétal dans le cas d'une cétone ou un hémiacétal
dans le cas d'un aldéhyde.
Lorsque la fonction carbonylée est mise en contact avec deux fonctions alcool, on obtient un cétal (pour une cétone) ou un acétal (pour un aldéhyde).
Bilans de ces réactions :

Caractéristiques de la réaction :
• Réversible
• Contrôlée thermodynamiquement
• Athermique (ΔrH°=0)
• Catalysée par H+
• Peu favorisée : en général K°<<1
Cette réaction se déroule en milieu acide. Cependant les solutions aqueuses de H+ sont interdites. En effet, l'eau est néfaste à l'équilibre.
H+ sera donc amené sous forme solide. Pour cela on peut utiliser l'
acide paratoluène sulfonique solideAcide paratoluène sulfonique solide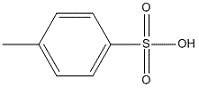 .
.
L'addition nucléophile de diols sur les carbonyles permet la formation de cétals ou d'acétals cycliques. Généralement on utilise l'éthan-1,2-diol.
Ces cétals ou acétals cycliques sont moins défavorisés thermodynamiquement.
Bilan :
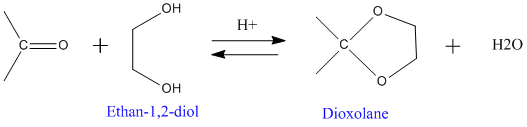
Cette réaction est réversible et l'équilibre peut être déplacé facilement. En effet une hydrolyse acide retransforme la molécule en aldéhyde ou
en cétone. Elles est donc utilisée pour protéger les fonctions carbonyles.
Dans le sens direct : excès de diol ou retrait d'eau
Dans le sens indirect : ajout d'eau
Cette molécule résiste :
• Aux oxydants
• Aux hydrures
• Aux nucléophiles en milieu basique