Applications des fonctions usuelles à la chimie
Avant tout nous pouvons voir l'utilité des fonctions usuelles en
cinétique chimique, en
chimie nucléaire
Soit la réaction suivante :
x Ox + n e- ⇔ y Red
Alors la loi de Nernst est :
E = E0 +
Et à 25°C
≈ 0.06 V, en supposant les activités égales aux concentrations on a :
E = E0 + 0,06 log
Avec :
- R la constante des gaz parfaits et R = 8.314 S.I.
- T la température (en K)
- ai l’activité de i
- F la constante de Faraday et F = 96500 C.mol-1
Exemple d’application
Zn + Cu2+ ⇒ Zn2+ + Cu

by CALLAUD Pierre
Par une mesure de potentiel, on peut trouver facilement le K
0 de cette réaction :
A l'équilibre tous les potentiels sont égaux donc
E(Zn/Zn2+) = E(Cu/Cu2+)
Soit (2 électrons échangés)
E0(Zn/Zn2+)+ 0,03 ln [Zn2+] = E0(Cu/Cu2+)+ 0,03 ln [Cu2+]
D'où
K0 =
Or E
0(Zn/Zn
+2) = 0,76 V et E
0(Cu/Cu
+2) = 0,345 V
Donc
K0 = 1013,8
Potentiel chimique
L’expression générique du potentiel chimique est : µ
i = µ
0 + RT ln(a
i)
Démonstration dans le cas des gaz parfaits
Pour un gaz parfait, nous avons :
= =d'après la loi PV = nRT
D’où en intégrant, on obtient :
µ*(T,P,GP)=µ0(T,P,GP) + RT ln()
On en déduit que pour un gaz parfait :
aGP= avec P0 = 1 bar
Intérêt du potentiel chimique :
A l’équilibre, les potentiels de toutes les espèces chimiques en présence sont égaux.
ΔrG=-A=
D’où on obtient :
ΔrG=ΔrG0+RTlnQ
Donc à l’équilibre,
ΔrG=0 et Q=K0
nous avons alors :
K0=
Le potentiel chimique permet de déterminer le sens de l’évolution d’un système chimique car le potentiel tend toujours à se minimiser.
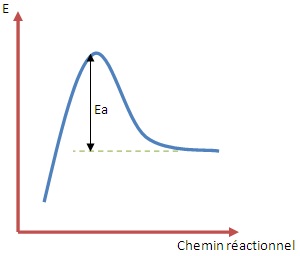
Loi d'Arrhénius
La Loi d'Arrhénius est une loi empirique qui donne l'influence de la température sur la constante de vitesse k d'une réaction :
Soit, en supposant que Ea constant
k =
Avec Ea l'énergie d'activation de J.mol
-1,
by CALLAUD Pierre
R la constante des gaz parfait et T la température de K.
A est appelé facteur de fréquence, il est exprimé dans la même unité que k.

Ce(tte) oeuvre est mise à disposition selon les termes de la
Licence Creative Commons Paternité - Pas d'Utilisation Commerciale 3.0 France.





