


Applications des équations différentielles à la chimie
Cinétique chimique
Réaction d'ordre 0 à un réactif
Soit la réaction :Condition initiale : [A](t=0)=[A]0
Définition : une telle réaction d'ordre 0 a une vitesse v== constante.
Donc =k soit d[A]=-kdt en intégrant entre t=0 et un instant t quelconque on a :
Réaction d'ordre 1 à un réactif
Soit la réaction :Conditions initiale : [A](t=0)=[A]0
Définition : une telle réaction d'ordre 1 a une vitesse de la forme v=k[A].
On a donc l'équation différentielle :
Soit
D'où en intégrant entre t=0 et un instant t quelconque on a :
ln()=-kt donc [A]=[A]0 e-kt
Réaction d'ordre 2 à un réactif
Soit la réaction :Condition initiale : [A](t=0)=[A]0
Définition : une telle réaction d'ordre 2 a une vitesse de la forme v=k[A]².
On a donc l'équation différentielle :
Soit
D'où en intégrant entre t=0 et un instant t quelconque on a :
Réaction d'ordre n (n>1) à un réactif
Soit la réaction :Condition initiale : [A](t=0)=[A]0
Définition : une telle réaction d'ordre n a une vitesse de la forme v=k[A]n.
On a donc l'équation différentielle :
Soit
D'où en intégrant entre t=0 et un instant t quelconque on a :
Exemples cinétiques de réactions

by CALLAUD Pierre
Chimie nucléaire
Définition : la radioactivité est la transformation (ou désintégration) de noyaux instables en d'autres noyaux.Elle est la plupart du temps acompagnée d'émission de particules () mais aussi de rayonnements électromagnatiques (γ).
L'utilité des équations différentielles se trouve dans la loi de décroissance radioactive.
Définition : L'activité d'un échantillon radioactif (A) correspond au nombre de désintégration par unité de temps, donc A= (1). Avec dN (sans unité) le nombre de noyaux désintégrés au bout d'une durée dt (en s). L'activité A s'exprime en Becquerels (i.e. en nombre de désintégrations par seconde).
La loi de décroissance radioactive nous dit que: l'activité A est proportionnelle au nombre de noyaux radioactifs N.
Soit tels que A =λN (2) (λ la constante radioactive, caractéristique à un noyau radioactif).
En utilisant les équations (1) et (2) on en déduit que λN += 0.
D'où N = avec le nombre de noyau radioactif à t = 0.
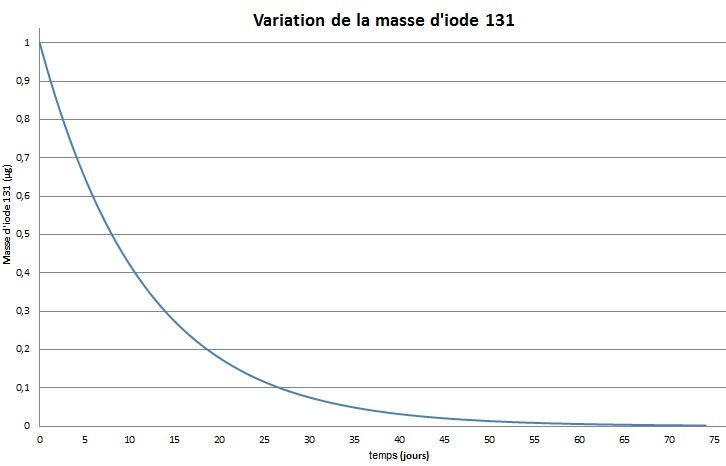
L'iode 131
Prenons l'exemple de l'iode 131 qui a une période de demi-vie de 8,02 jours soit une constante radioactive λ de 0,783 jours-1.Pour 1 µg(=N0) de l'iode 131 on obtient la courbe suivante :
by CALLAUD Pierre

Ce(tte) oeuvre est mise à disposition selon les termes de la Licence Creative Commons Paternité - Pas d'Utilisation Commerciale 3.0 France.