Nous allons maintenant vous présenter la réactivité des époxydes. Cette partie pourra vous être utile pour résoudre les exercices.

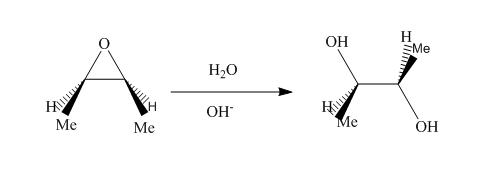
La réaction d’hydrolyse des époxydes est lente, sauf si elle est catalysée en milieu acide ou basique. Cette réaction forme des diols.
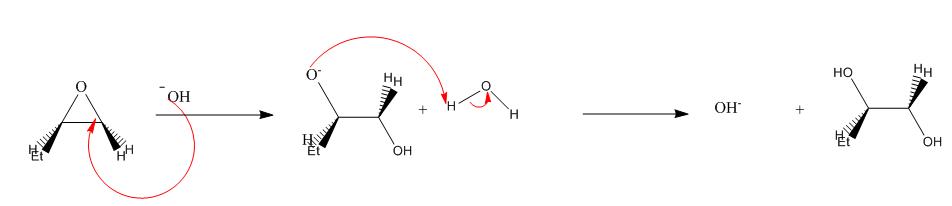
1)Mécanisme en milieu basique
Bilan de la réaction :
Mécanisme :
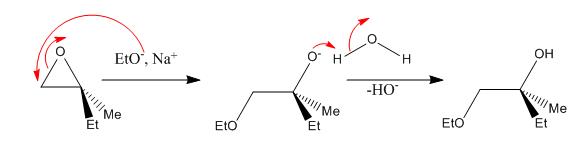
OH- attaque préférentiellement du côté le moins encombré de l’époxyde.
L’oxygène capte un proton de l’eau, ainsi HO- est régénéré et on obtient un diol.
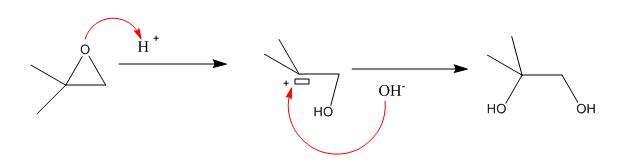
2) Mécanisme en milieu acide
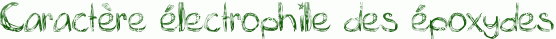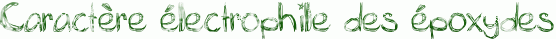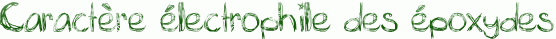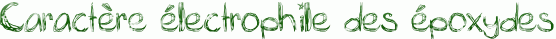
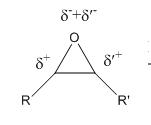
Les époxydes sont des électrophiles. En effet, comme on le remarque dans le schéma ci-dessous, l’oxygène de l’époxyde porte une charge δ- alors que les carbones portent une charge δ+ car Χ(O)>Χ(C).
L’époxyde étant un électrophile, il va donc réagir avec un nucléophile au niveau des carbones, sites déficitaires en électrons.
La majorité des réactions seront des SN2, le carbone attaqué sera donc celui qui est le plus disponible c’est-à-dire le moins substitué.
Ex 1 : alcoolates
Ex2 : ions alcynures
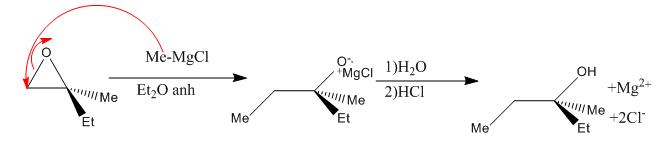
D’ailleurs la réaction la plus connue d’un époxyde en tant qu’électrophile est la
réaction avec un réactif de Grignard nucléophile.

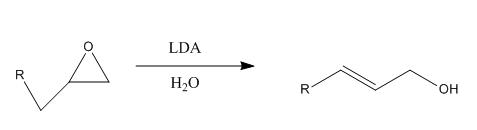
Les époxydes peuvent aussi avoir un caractère acide et peuvent donc être déprotonés par une base forte.
Ex :
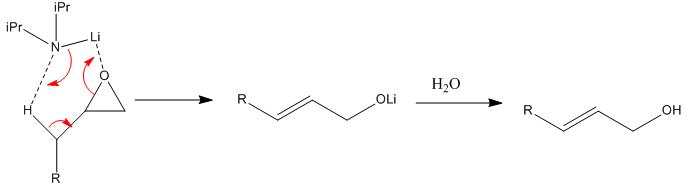
On formera ainsi des alcools allyliques.



 Mécanisme :
Mécanisme :